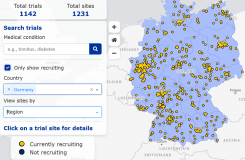
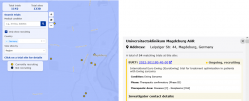
Das DRKS (Deutsches Register Klinischer Studien) bietet allen interessierten und potentiellen StudienteilnehmerInnen die Möglichkeit, Informationen zu laufenden und abgeschlossenen klinischen Studien in Deutschland, insbesondere der UMMD, zu suchen.
Das DRKS enthält inzwischen mehr als 12.000 Studien. Zu jeder Studie findet man Eckdaten wie Standort, Klinik, Studientitel, Kurzbeschreibungen, Ein- und Ausschlusskriterien, Indikationen, Studienstatus und Endpunkte.
Für die Suche nach Studien können Sie den Suchbegriff direkt in die Suchbox eingeben.
Registrierung klinischer Studien in einem öffentlichen Studienregister

Das DRKS ist das deutsche Primärregister zur Registrierung Klinischer Studien bei der WHO.
Wir bieten Ihnen die Eingabe Ihrer akademischen klinischen Studie sowohl prospektiv als auch retrospektiv, d.h. nach bereits erfolgtem Studienbeginn, oder die Unterstützung bei der Eingabe durch Sie selber an.
Das International Committee of Medical Journal Editors (ICMJE) fordert für alle klinischen Studien, die bei einem der beteiligten Journals veröffentlicht werden sollen, eine prospektive Registrierung in einem von der ICMJE anerkannten Register, dazu gehört auch das DRKS.
In der aktuellen Version der Deklaration von Helsinki von Oktober 2013 wird diese Transparenz ebenfalls gefordert und vom Arbeitskreis Med. Ethikkommissionen Deutschlands unterstützt:
Registrierung von Forschung sowie Publikation und Verbreitung von Ergebnissen
35. Jedes Forschungsvorhaben, an dem Versuchspersonen beteiligt sind, ist vor der Rekrutierung der ersten Versuchsperson in einer öffentlich zugänglichen Datenbank zu registrieren.
36. Forscher, Verfasser, Sponsoren, Herausgeber und Verleger haben im Hinblick auf die Veröffentlichung und Verbreitung der Forschungsergebnisse ethische Verpflichtungen. Forscher sind verpflichtet, die Ergebnisse ihrer Forschung am Menschen öffentlich verfügbar zu machen und sind im Hinblick auf die Vollständigkeit und Richtigkeit ihrer Berichte rechenschaftspflichtig. Alle Beteiligten sollen anerkannten Leitlinien für ethische Berichterstattung („ethical reporting“) folgen. Negative und nicht schlüssige Ergebnisse müssen ebenso wie positive veröffentlicht oder in anderer Form öffentlich verfügbar gemacht werden. In der Publikation müssen Finanzierungsquellen, institutionelle Verbindungen und Interessenkonflikte dargelegt werden. Berichte über Forschung, die nicht mit den Grundsätzen dieser Deklaration übereinstimmt, sollten nicht zur Veröffentlichung angenommen werden.